技術背景
2018 年以來,越來越多的藥物研發機構開始注意到單細胞測序技術在藥物研發上的優勢。首先是通過分析不同病人樣本的單細胞圖譜來挖掘潛在的靶點(細胞、通路和分子),主要是在 RNA 和蛋白水平上篩選及驗證細胞特異性表達的藥物靶標。其次,探究病人組織微環境中細胞類型與分子特征的相關性,如靶標與特定的免疫細胞或基質細胞、信號通路、空間位置、受體配體等的相關性,從而更好地確定靶標的作用方式及細胞 - 細胞相互作用。一旦確定了靶點,需將候選模型與病人的單細胞表達譜進行比較,以確定匹配的模型。并且單細胞測序還能用于進一步探究細胞構成及基因表達在用藥前后的變化,及治療有效 / 無效之間的差異,以評估治療過程及新藥物的有效性;此外,對不同藥物及其組合進行單細胞測序比較,還可篩選治療組合。

為什么 更多科研工作者 選擇 伯豪生物單細胞測序技術服務?
2020 年,行業首份《單細胞測序行研報告》系伯豪生物編寫、聯合出版;
2021 年,Bio-protocol 單細胞測序技術實驗方法復現集系伯豪生物聯合出版;
●大樣本量驗證:30 萬樣本 / 年,伯豪專業技術服務團隊實驗經驗豐富;
●嚴格質量標準:QA 系統為您實驗全程護航,實驗嚴格按照 156 個 SOP 文件進行;
●實驗記錄完備: 嚴格的流水線作業項目管理流程,保證所有實驗記錄可供回溯;
●多重實驗質控: 實驗室 QC、數據分析 QC、項目管理 QC,3 重 QC 有效減少低質量數據。
伯豪生物 單細胞測序技術 能夠應用到哪些領域?
單細胞測序技術以其高通量、高分辨率的特點,使人們開始意識到它在藥物研發中的巨大潛力,包括在單細胞水平上進行高通量地藥物靶點篩選、藥代動力學分析、藥效評價等,極大地縮減藥物發現周期、節約新藥研發成本。單細胞測序技術為新藥研發注入新的希望,有助于藥物研發機構優化新藥研發管線。
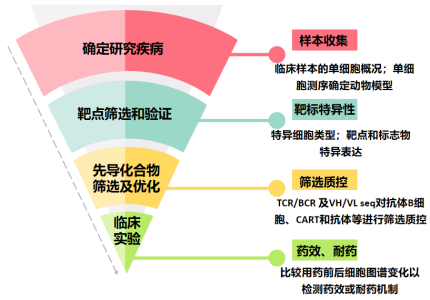
▲驅動藥物開發的單細胞測序技術

案例 1:
2018 高級別漿液性卵巢癌(high-grade serous ovarian carcinoma)是致死率高的婦科惡性腫瘤。目前對漿液性卵巢癌的治療方案創新極其受限,主要原因之一就是缺乏一個穩定的腫瘤分子分型體系。2020 年 2 月 10 日,牛津大學 Weatherall 分子醫學研究所 Ahmed A. Ahmed 實驗室和曼徹斯特大學 Christopher Yau 研究組在 Cancer Cell(IF=26.6)雜志發表相關研究論文 [1]。這項研究通過深度單細胞 RNA 測序技術 Smart-Seq2 刻畫了人輸卵管上皮組織,共測序了約 6000 個主要來自非卵巢癌病人的正常輸卵管上皮細胞(非癌細胞),發現并驗證了輸卵管上皮內的 6 種新細胞亞型,包括 4 種分泌細胞亞型,1 種分泌 - 纖毛中間態細胞亞型以及 1 種特殊的組織原位 T 細胞。非癌癥病人和癌癥病人的輸卵管上皮細胞都有 Cellcycle, EMT, Differentiated 和 KRT17 cluster 四個亞群的細胞。通過分析發現 TCGA 和 AOCS 數據庫很大比例的樣本都可以通過 52 個 marker 基因(7 differentiated markers, 10 KRT17 cluster markers, 12 EMT markers, 15 cell-cycle markers, 和 8 ciliated markers)形成的 panel 進行主要分群。研究者們進一步發現“分解”分析(deconvolution)中的 EMT(epithelial-mesenchymal transition,上皮 - 間質轉化)細胞狀態的比例和病人預后顯著負相關,12 個 EMT marker 顯示表達比例越高的病人其生存期越低,且這一相關性在九個獨立數據庫中都可被重復出來。為了進一步證明 EMT 及其他四種細胞狀態的信號可來自于癌細胞,研究者們利用激光捕獲顯微切割技術(LCM)獲取了純度更高的腫瘤樣本,并進行了轉錄組測序,對 LCM 樣本數據分析重現了在 TCGA 等公共數據庫里的發現,并通過免疫熒光染色在組織切片和卵巢癌細胞系 KURAMOCHI 中進行了驗證。總之,這項研究利用單細胞測序定義了一個腫瘤分子分型體系,對卵巢癌的預后分析帶來重要影響。
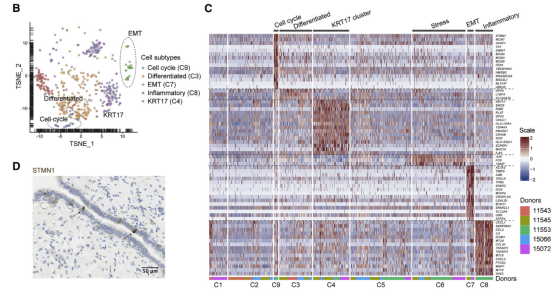
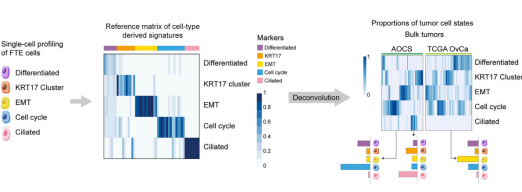
案例 2:
CD73 是一個抗腫瘤的熱門靶點。免疫檢查點療法(ICT),例如抗 CTLA- 4 和抗 PD-1/PD-L1 已經極大地變革了人們對多種腫瘤的治療方式。但是臨床上只對部分特定腫瘤類型的患者提供持久的抗腫瘤反應。腫瘤特異性免疫檢查點靶向的機制基礎尚不清楚。為了深入了解腫瘤特異性免疫調節靶點,來自美國德克薩斯大學 MD 安德森癌癥中心 Padmanee Sharma 研究團隊通過分析多種病人來源的 5 種不同類型腫瘤中浸潤的免疫細胞分型,發現了神經膠質瘤中特異性存在 CD73(hi) 的巨噬細胞。研究團隊對四個 GBM 腫瘤進行了單細胞 RNA 測序 [3],細胞分成了 17 個亞群,包含了 4 個 CD3+ T 細胞和 10 個 CD3?CD68+ 髓系細胞。在 10 個 CD3?CD68+ 髓系細胞中,其中有 4 個是 CD73(hi)。ScRNA-seq 顯示 CD73(hi) 髓樣細胞富含免疫抑制基因,并且具有與常駐小膠質細胞特征不同的特征。將 CD73 巨噬細胞的基因與癌癥基因組圖譜(TCGA) 中的膠質母細胞瘤樣本進行比較,結果表明 CD73 高表達的巨噬細胞的基因特征與存活率下降相關。研究人員分析了 5 名接受過 PD- 1 抑制劑 Keytruda 治療和 7 名未接受過 PD- 1 抑制劑治療的膠質母細胞瘤患者,均發現了表達 CD73 的巨噬細胞簇,說明抗 PD- 1 治療沒有使膠質母細胞瘤的微環境發生明顯改變。
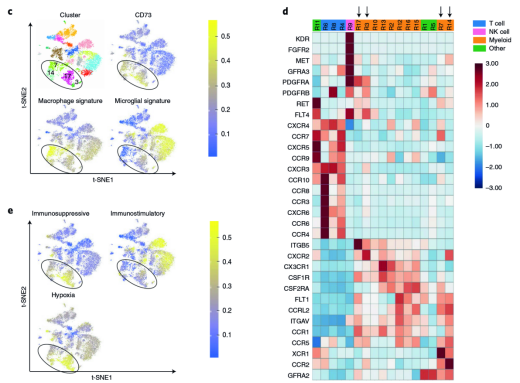
▲圖 CD73(hi) 巨噬細胞特異性存在于 GBM 中 [2]
為驗證 CD73 是否可以在 GBM 治療中作為一種聯合治療的靶點。研究人員在 WT 和 CD73-/- 小鼠中構建 GL261 GBM 腫瘤模型,CD73 的缺失可以通過調控腫瘤內髓系細胞的亞群改變而提高小鼠生存。同時,CD73 的缺失可以提高 GBM 小鼠模型對抗 PD- 1 和抗 CTLA- 4 聯合治療的響應,提高了 iNOS+ 免疫刺激巨噬細胞和顆粒酶素 B + CD8 T 細胞在瘤內比例。腫瘤微環境中存在多種免疫檢查點,本研究通過對多種不同類型腫瘤細胞浸潤免疫細胞分析,發現不同免疫檢查點的存在是有腫瘤類型特異性的,其中 CD73hi 髓系細胞亞群,特異性出現在 GBM 中,靶向 CD73 分子可提高機體對免疫檢查點療法的響應和療效。
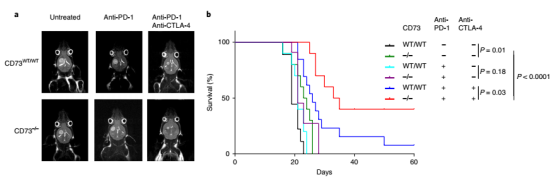
▲圖 在 GBM 小鼠模型中,CD73 的缺失增強了 ICT 的療效 [2]
引用文獻:
[1]. Hu Z, Artibani M, Alsaadi A, et al. The Repertoire of Serous Ovarian Cancer Non-genetic Heterogeneity Revealed by Single-Cell Sequencing of Normal Fallopian Tube Epithelial Cells[J]. Cancer Cell, 2020, 37(2):226-242.
[2]. Goswami S, Walle T, Cornish A E, et al. Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma[J]. Nature Medicine, 2020, 26(1):1-8.
案例 1:抗體藥 PD1/PDL1
腫瘤浸潤性淋巴細胞(tumor infiltrating lymphocytes, TIL):浸潤在腫瘤內的淋巴細胞,以 T 細胞為主,也含有其他免疫細胞。由于里邊含有能夠識別殺傷腫瘤的 T 細胞(腫瘤反應性 T 細胞,tumor reactive T cells)而備受關注。阻斷 T 細胞抑制性檢查點受體的免疫療法已經改變了癌癥患者的臨床護理。然而 T 細胞對檢查點阻斷的反應是否依賴于預先存在的腫瘤浸潤淋巴細胞的再激活或新 T 細胞的募集尚不清楚。2019 年一項發表于 Nature Medicine 上的研究從 11 位診斷為基底細胞癌患者接受 PD- 1 抑制劑治療前后的組織標本中獲取 T 細胞進行 RNA 單細胞測序和 TCR 測序,以研究 PD- 1 抑制劑是否通過腫瘤浸潤 T 細胞的“再激活”或是通過招募新的 T 細胞到達腫瘤區域發揮抗腫瘤效應 [3]。
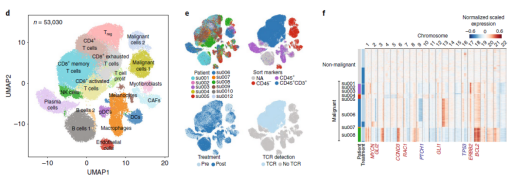
▲圖 11 例患者治療前后所有腫瘤細胞聚類 [3]
本研究的重點是免疫細胞,尤其是浸潤性免疫細胞,以及治療前后的變化,以了解克隆性 T 細胞對 PD- 1 抗體治療的反應。因此研究人員把所有的 33106 個腫瘤浸潤性 T 細胞做了個更細致的分類,包括表達 CD4 的調節性 T 細胞(Treg)細胞,濾泡輔助性 T(TFH)細胞,T 輔助細胞 17(TH17)細胞;以及表達 CD8 的幼稚細胞,記憶 T 細胞,效應記憶 T 細胞,活化 T 細胞,慢性活化 / 耗竭 T 細胞,中度耗竭 / 活化細胞。進一步分析發現,在 PD- 1 抗體治療之后,濾泡輔助性 T 細胞,以及活化,耗竭和耗竭 / 活化的 CD8 陽性 T 細胞的頻率增加,并且耗竭 T 細胞的克隆水平明顯更高。更為讓研究人員感到意外的是,對于同一個患者而言,治療后記憶 T 細胞和效應 T 細胞頻繁轉換為活化狀態,但是治療前的耗竭 T 細胞卻沒有變成治療后的非耗竭表型。這表明,即使在 PD- 1 抗體治療后,已經耗竭的腫瘤浸潤 T 細胞也很難再變成活化狀態。此外,研究人員還觀察到一個有趣的現象,PD- 1 抗體治療后才出現的耗竭性 T 細胞表現出了新的 TCR 特異性。為了分析外周血中是否存在新發現的腫瘤浸潤性 T 細胞,研究人員給患者的血液樣品做了 TCR 測序,發現 35.5% 新腫瘤浸潤性 T 細胞可以在 PD- 1 抗體治療后的外周血中找到,而在治療前的外周血中只能找到 11.8% 的新腫瘤浸潤性 T 細胞,不過治療前的腫瘤里面卻沒有新腫瘤浸潤性 T 細胞。總的來說,與“冷”腫瘤相比,“熱”腫瘤之所以響應 PD- 1 抗體的治療,可能是由于“熱”腫瘤自身的特性,讓它能夠不斷吸引新 T 細胞進入,而不是重新激活已有的腫瘤浸潤性 T 細胞。這項研究讓我們對免疫檢查點抑制劑的作用機制有了新的認知,這對臨床治療和療效的檢測都有一定的價值和意義。
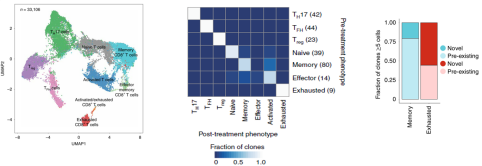
案例 2:細胞治療
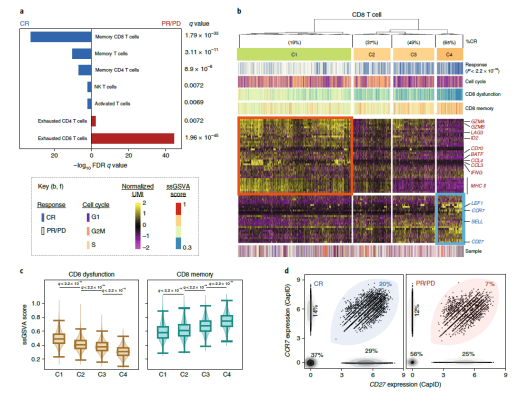
目前,以 CD19 為靶點的 CAR- T 細胞治療已被證明對復發性、難治性 B 細胞惡性腫瘤如 B 細胞非霍奇金淋巴瘤(NHL)、急性淋巴細胞白血病(ALL)和慢性淋巴細胞白血病(CLL)有顯著的治療作用 [4]。雖然抗 CD19 CAR- T 細胞治療的早期結果令人欣喜,但是只有不到一半的患者出現了長期的緩解,這意味著大多數患者在接受治療后要么沒有反應要么出現了復發。CAR- T 細胞治療在不同患者中出現的這些差異的原因到底是什么?2020 年 10 月 5 日在線發表在《Nature Medicine》雜志上的文章探討了這一問題。對 24 例大 B 細胞淋巴瘤(LBCL) 患者輸注自體 CAR- T 細胞后,研究人員對 137,326 個殘留的細胞進行了全轉錄組 scRNA-seq[5]。
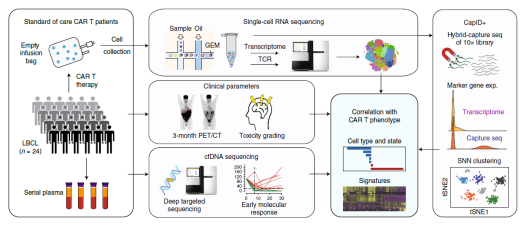
▲圖 工作流程圖 [5]
比較全部恢復(CR) 患者和疾病進行 / 部分恢復(PR/PD) 患者輸注產物的細胞類型和功能狀態,研究人員發現 PR/PD 患者的輸注產物中衰竭的 CD8 和 CD4 T 細胞顯著富集,而 CR 患者的輸注產物中記憶 CD8 T 細胞顯著富集。CR 患者和 PR/PD 患者 CD8 T 細胞的差異表達基因(DEG)鑒定出 4 類細胞群,這些差異表達基因大多與 CD8 T 細胞的激活和衰竭有關,雖然每個細胞群都包含來自所有患者的細胞,但是來自 CR 患者的細胞的相對比例在各個細胞群之間存在顯著差異。CD4 T 細胞的 DEG 分析和聚類也表現出類似結果,不同的是增殖相關基因和周期細胞在 CR 患者的高頻細胞聚類中表達較高。由此強調了與臨床療效相關的 CAR- T 細胞輸注產物細胞的重要轉錄特征。研究表明輸注的 CAR T 細胞產物的細胞和分子多樣性是導致經抗 CD19-CAR- T 細胞治療的 LBCL 患者療效和毒性差異的主要因素,與輸注產物相關的可量化表型可通過在其產生過程中富集所需的、或消除不期望的細胞群體或功能狀態而發揮作用。對離散細胞群導致反應不良或高毒性的機制的了解,可能有助于發現治療干預的途徑,從而提高療效,降低 CAR- T 細胞輸注后的毒性。
引用文獻
[3]. Li X, Wang M, Xiang R. Clonal replacement of novel T cells: a new phenomenon in the tumor microenvironment following PD-1 blockade[J]. Signal Transduction and Targeted Therapy, 2019, 4:43.
[4] Neelapu Sattva S, Locke Frederick L, Bartlett Nancy L, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. New England Journal of Medicine, 2017, 377:2531-2544.
[5] Deng Qing, Han Guangchun, Puebla-Osorio Nahum, et al. Characteristics of anti-CD19 CAR T cell infusion products associated with efficacy and toxicity in patients with large B cell lymphomas[J]. Nature Medicine, 2020, 26:1878-1887.
案例 1:病毒疫苗
謝曉亮教授團隊利用高通量單細胞 RNA 和 VDJ 測序平臺,從 60 位康復期病人身上篩選出 8558 種病毒蛋白結合抗體序列,成功找出 14 株高活性的中和抗體。其中編號為 BD-368- 2 的抗體表現突出,在假病毒實驗中的半抑制濃度(IC50)達到 1.2 ng/mL(8pM);在軍事醫學研究院 P3 實驗室進行的真病毒實驗中,IC50 達到 15 ng/mL(100pM)。中和抗體體內抗病毒實驗進一步證實,利用 hACE2 轉基因小鼠模型,感染 SARS-Cov- 2 后給予 BD-368- 2 的治療使病毒載量下降~2400 倍。而注射 BD-368- 2 后可完全抑制小鼠的病毒感染,達到預防效果。研究團隊還利用冷凍電鏡得到新冠病毒 Spike 三聚體與中和抗體的高分辨率 3.8?三維結構密度圖。數據顯示,抗原上的中和抗體表位與 ACE2 的結合位點重合,從而揭示出中和作用的結構基礎。此外,研究人員還證明了可以根據 CDR3H 結構的相似性來選擇 SARS-CoV- 2 中和抗體 [7]。
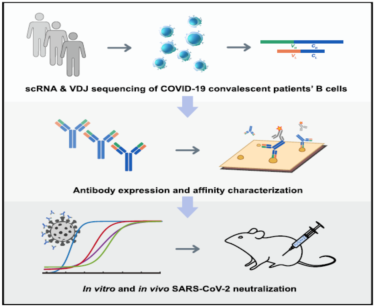
案例 2:病毒疫苗
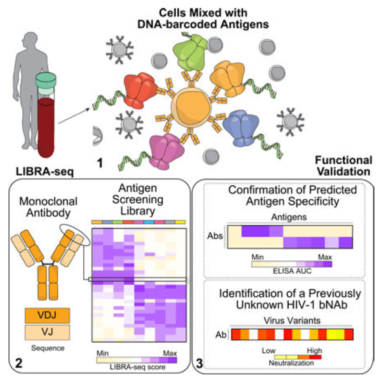
范德比爾特大學的研究組在 Cell 雜志上發表文章 [8],提出了一種名為 LIBRA-seq 的新的測序技術。作者構建了一個特殊的抗原庫,將抗原連接上 DNA 條碼和用于流式細胞術分選的熒光標簽。接下來,將這個庫與富含 B 細胞的樣本共孵育。將連有熒光標簽的抗原和與之結合的 B 細胞共同分選出來,并進行測序,從而得到 BCR- 抗原序列圖譜。利用 LIBRA-seq,研究人員繪制了來自兩名 HIV 感染者的數千個 B 細胞的抗原特異性圖譜,許多 HIV 和流感特異性抗體的預測特異性得到證實。這項技術可以有效地繪制 BCR 序列及其對應的特異性抗原圖譜,在抗體研發和疫苗制備領域具有廣泛的應用。
案例 3:個性化腫瘤疫苗
NeoVax 是一種新抗原(Neoantigen)腫瘤疫苗,主要以新抗原為靶點。新抗原通常是腫瘤細胞在發生發展過程中,隨機突變產生的新的蛋白質或多肽,一般特異性表達于腫瘤細胞中但不存在與正常組織細胞中。因此,新抗原也成為了腫瘤免疫治療的理想靶點。早在 2017 年,美國 Dana Farber 癌癥研究所應用 NeoVax 治療惡性黑色素瘤患者,并取得的良好療效。6 名高復發風險的患者在術后 18 周開始接受 NeoVax 疫苗治療。在接種后的 2 年多時間內,4 名患者未發現腫瘤復發;另外 2 名惡性黑色素瘤伴肺轉移的患者,在接種疫苗后復發,隨即開始接受 PD-1 單抗藥物的治療,也獲得完全緩解并處于無疾病進展狀態 [9]。為了進一步探究 NeoVax 腫瘤疫苗的遠期臨床療效及其機制,研究人員對上述 6 名患者及新入組的 2 名患者進行長期隨訪。在術后 4 年多(55 個月)的中位數隨訪中,8 名患者全部存活,其中 3 名患者仍未出現復發。復發的 5 名患者中,2 名 IV 期患者接受 pembrolizumab(PD- 1 單抗)治療后完全緩解(2017 年已報道),1 名患者接受了手術切除且仍未發現疾病證據(NED),2 名患者發展為不可切除的轉移性疾病。
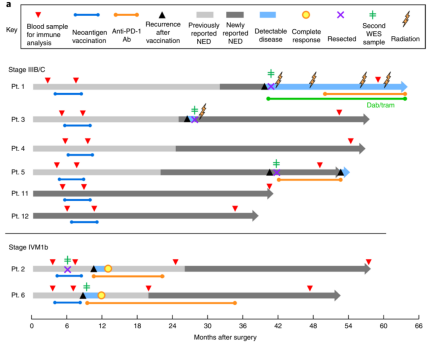
對于如此令人興奮的長期臨床療效,研究人員期望揭示患者體內的變化和機制。研究人員首先試圖確定 NeoVax 疫苗誘導的特異性 T、細胞在外周血中的功能狀態是如何演變的。他們對新抗原特異性 T 細胞,尤其是 CD4+ T 細胞的特征進行了跟蹤和分析。結果發現,NeoVax 疫苗誘導的新抗原特異性 CD4+ T 細胞表現出記憶性和細胞毒性特征。進一步分析了這些患者的 T 細胞,發現這些患者體內不僅產生了靶向的目標新抗原的特異性 T 細胞,而且還擴展到識別其他與黑色素瘤相關的新抗原,起到了更強更持久的抗腫瘤效果 [10]。

引用文獻:
[7]. Yunlong Cao, Bin Su, Xianghua Guo, et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identified by High-Throughput Single-Cell Sequencing of Convalescent Patients’B Cells[J]. Cell, 2020, 182(1):73-84.
[8]. Setliff I, Shiakolas A R, Pilewski K A, et al. High-Throughput Mapping of B Cell Receptor Sequences to Antigen Specificity[J]. Cell, 2019, 179(7):1636-1646.
[9]. Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662):217-221.
[10]. Zhuting Hu, Donna E Leet, Rosa L Alles?e, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma[J]. Nature Medicine, 2021, 27(3):515-525.
案例 1:病毒疫苗
謝曉亮教授團隊利用高通量單細胞 RNA 和 VDJ 測序平臺,從 60 位康復期病人身上篩選出 8558 種病毒蛋白結合抗體序列,成功找出 14 株高活性的中和抗體。其中編號為 BD-368- 2 的抗體表現突出,在假病毒實驗中的半抑制濃度(IC50)達到 1.2 ng/mL(8pM);在軍事醫學研究院 P3 實驗室進行的真病毒實驗中,IC50 達到 15 ng/mL(100pM)。中和抗體體內抗病毒實驗進一步證實,利用 hACE2 轉基因小鼠模型,感染 SARS-Cov- 2 后給予 BD-368- 2 的治療使病毒載量下降~2400 倍。而注射 BD-368- 2 后可完全抑制小鼠的病毒感染,達到預防效果。研究團隊還利用冷凍電鏡得到新冠病毒 Spike 三聚體與中和抗體的高分辨率 3.8?三維結構密度圖。數據顯示,抗原上的中和抗體表位與 ACE2 的結合位點重合,從而揭示出中和作用的結構基礎。此外,研究人員還證明了可以根據 CDR3H 結構的相似性來選擇 SARS-CoV- 2 中和抗體 [7]。

案例 2:病毒疫苗
范德比爾特大學的研究組在 Cell 雜志上發表文章 [8],提出了一種名為 LIBRA-seq 的新的測序技術。作者構建了一個特殊的抗原庫,將抗原連接上 DNA 條碼和用于流式細胞術分選的熒光標簽。接下來,將這個庫與富含 B 細胞的樣本共孵育。將連有熒光標簽的抗原和與之結合的 B 細胞共同分選出來,并進行測序,從而得到 BCR- 抗原序列圖譜。利用 LIBRA-seq,研究人員繪制了來自兩名 HIV 感染者的數千個 B 細胞的抗原特異性圖譜,許多 HIV 和流感特異性抗體的預測特異性得到證實。這項技術可以有效地繪制 BCR 序列及其對應的特異性抗原圖譜,在抗體研發和疫苗制備領域具有廣泛的應用。

案例 3:個性化腫瘤疫苗
NeoVax 是一種新抗原(Neoantigen)腫瘤疫苗,主要以新抗原為靶點。新抗原通常是腫瘤細胞在發生發展過程中,隨機突變產生的新的蛋白質或多肽,一般特異性表達于腫瘤細胞中但不存在與正常組織細胞中。因此,新抗原也成為了腫瘤免疫治療的理想靶點。早在 2017 年,美國 Dana Farber 癌癥研究所應用 NeoVax 治療惡性黑色素瘤患者,并取得的良好療效。6 名高復發風險的患者在術后 18 周開始接受 NeoVax 疫苗治療。在接種后的 2 年多時間內,4 名患者未發現腫瘤復發;另外 2 名惡性黑色素瘤伴肺轉移的患者,在接種疫苗后復發,隨即開始接受 PD-1 單抗藥物的治療,也獲得完全緩解并處于無疾病進展狀態 [9]。為了進一步探究 NeoVax 腫瘤疫苗的遠期臨床療效及其機制,研究人員對上述 6 名患者及新入組的 2 名患者進行長期隨訪。在術后 4 年多(55 個月)的中位數隨訪中,8 名患者全部存活,其中 3 名患者仍未出現復發。復發的 5 名患者中,2 名 IV 期患者接受 pembrolizumab(PD- 1 單抗)治療后完全緩解(2017 年已報道),1 名患者接受了手術切除且仍未發現疾病證據(NED),2 名患者發展為不可切除的轉移性疾病。

對于如此令人興奮的長期臨床療效,研究人員期望揭示患者體內的變化和機制。研究人員首先試圖確定 NeoVax 疫苗誘導的特異性 T、細胞在外周血中的功能狀態是如何演變的。他們對新抗原特異性 T 細胞,尤其是 CD4+ T 細胞的特征進行了跟蹤和分析。結果發現,NeoVax 疫苗誘導的新抗原特異性 CD4+ T 細胞表現出記憶性和細胞毒性特征。進一步分析了這些患者的 T 細胞,發現這些患者體內不僅產生了靶向的目標新抗原的特異性 T 細胞,而且還擴展到識別其他與黑色素瘤相關的新抗原,起到了更強更持久的抗腫瘤效果 [10]。

引用文獻:
[7]. Yunlong Cao, Bin Su, Xianghua Guo, et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identified by High-Throughput Single-Cell Sequencing of Convalescent Patients’B Cells[J]. Cell, 2020, 182(1):73-84.
[8]. Setliff I, Shiakolas A R, Pilewski K A, et al. High-Throughput Mapping of B Cell Receptor Sequences to Antigen Specificity[J]. Cell, 2019, 179(7):1636-1646.
[9]. Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662):217-221.
[10]. Zhuting Hu, Donna E Leet, Rosa L Alles?e, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma[J]. Nature Medicine, 2021, 27(3):515-525.

