
伯豪生物華大時空轉錄組 FF 樣本 V1.3 產品服務解決方案,是同時以納米級分辨率和厘米級全景視場實現“組織到數據”的 整體解決方案,適用于新鮮冷凍(FreshFrozen,FF) 樣本。為幫助研究人員利用更高效的生化流程捕獲更多 的基因,實現對基因表達和細胞變化過程的精準解析,我們對該方案進行了全面升級。 在保持 Stereo-seq 高檢測分辨率的基礎上,升級后的時空轉錄組 FF V1.3 的整體性能更優異,可助力研究人員輕松獲得更多高質量數據, 結合全新升級的數據分析工具 , 真 正實現 Cellbin 水平深入探索和揭示細胞基因表達的奧秘。
比較前期 V1.2 版本,升級后的時空轉錄組 FF V1.3 的整體性能更優異,在保持原分辨率 500nm 基礎上,捕獲基因數顯著提升,工作流程更快速簡便,可以輕松完成 CellBin 分析,實現真正意義上的空間單細胞分 析。目前,時空轉錄組 FF V1.3 兼容 1cm×1cm 和 0.5cm×0.5cm 的芯片,兩種尺寸都兼容同片 ssDNA 染色 /H&E 染色以及單細胞分割。

圖 Stereo-seq 芯片大小

1、Stereo-seq 芯片上布滿了數十億規則陣列排布的單鏈線球狀 DNA 納米球(DNA NanoBall,DNB)。DNB 是以單鏈環狀 DNA 為模版,經過滾環擴增得到的產物,每個 DNB 直徑為 220nm,兩個 DNB 中心點間距 范圍為 500nm。
2、通過 DNBSEQ 技術對固定在芯片上的 DNB 進行測序,得到 Coordinate ID(CID) 信息,CID 和 DNB 坐標 位置一一對應,可以通過建立 CID 與坐標位置的映射關系,還原后續捕獲到的 mRNA 的空間為止。芯片上所有點的 CID 序列信息,都被編制成一個叫“MASK”的文件,這個 MASK 文件包含了每個點上 CID 序列的信息,后續用于分析。
3、DNB 經 Stereo-seq 生物方法合成攜帶 CID 的 DNB 后鏈接分子編碼(Molecular ID,MID 用于區分不同 轉錄本)和 Poly T 序列,后續可以實現對游離 mRNA 的捕獲。
4、組織樣本貼在芯片上,經過透化、反轉錄、二鏈合成、建庫、測序等步驟,將樣本中的基因信息準確獲取。

圖 Stereo-seq 技術原理
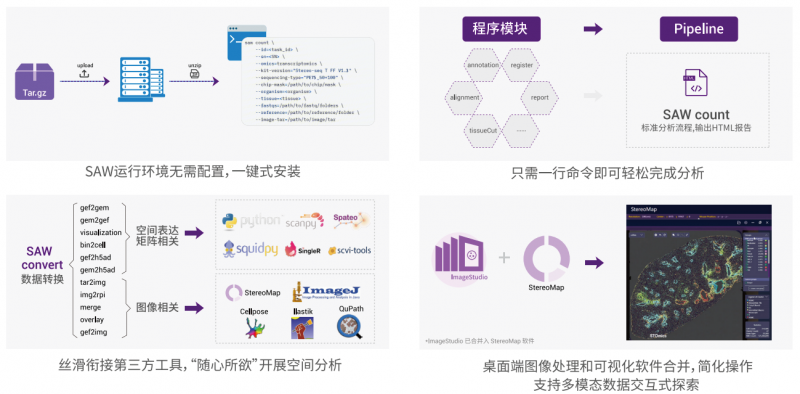
5、空間轉錄組數據分析的核心是根據每個芯片上每個 bin 的基因表達信息進行聚類,然后將 bin(cell bin)根據坐標位置序列放回到組織的圖像上,同時可以對每個 gene 在組織上表達的空間位置進行定位。Stereo-seq 分析軟件包括 Stereo-seq 分析流程軟件包(Stereo-seq Analysis Workflow, SAW)和 StereoMap(ImageStudio 已合并入 StereoMap)。SAW 主要用于分析空間基因表達數據,StereoMap 是一款 桌面端可視化軟件,可以實現圖像處理和交互式可視化探索。全新的分析軟件功能更加強大,操作更加簡單、5 伯豪生物華大時空轉錄組 FF V1.3 基因表達解決方案易用,以單細胞級分辨率(CellBin)輕松解析基因表達空間特征、探索全轉錄組空間奧秘。伯豪生物除了提 供 bin 基因數和 UMI 數統計、切片 bin 聚類和聚類亞群 marker 基因分析等基礎和高級分析,同時還提供個性 化分析,如特定 pathway 功能富集分析等。
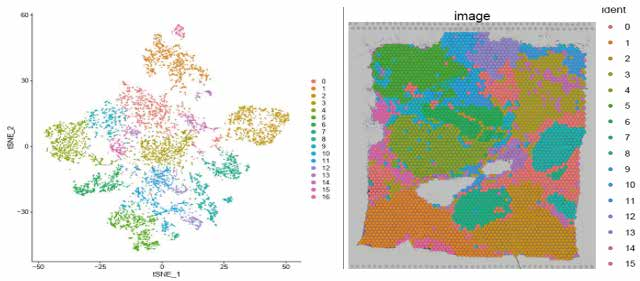
圖 聚類結果及切片 bin 位置分布展示

圖 每個 bin 特異表達的基因數統計
6、結合組織區域分布對數據進行挖掘
大部分組織其實是有其特定的區域劃分的,比如說大腦里有皮層、丘腦、海馬、脈絡叢等多個區域。 將組織的區域劃分和亞群(或細胞類型)的分布結合起來還是能發現很多有價值的信息的。
可以根據不同區域特異表達的 maker 基因的分布來判斷每個區域在組織切片上的位置。 例如皮層 marker 基因 STX1A 的表達分布,海馬 marker 基因 HPCA 的表達分布等
7、結合病理學特征對數據進行挖掘
空間轉錄組技術正真的精髓不是研究細胞亞群的分布,而在于將它在空間位置上體現的異質性跟組 織病理學特征的分布進行結合,挖掘在不同病理學特征下轉錄組學的差異。這對于研究疾病病變的機制、幫助臨床實現更好的患者分子分型、以及空間位置 Biomarker 的挖掘方面都是非常有價值的。通過手動把這些區域圈出來進行轉錄組層面的比較,找出不同病灶區的特異性 marker,分析疾病在一步步發展進程中生物學功能的變化,甚至可以思考一下是否能找出一些關鍵性因子來阻斷疾病的進展。
8、空間轉錄組聯合單細胞 RNA 測序解析細胞類型的空間位置信息(Multimodal intersection analy-sis,MIA)
空間轉錄組測序可以獲得不同基因在組織切片上的空間位置信息,但不能獲得詳細的細胞類群信息(空間轉錄組不是單細胞分辨率,只能粗略的分析切片上不同位置的細胞類型)。因此,需要借助但細胞測序數據來分析細胞類型,然后通過生物信息學的分析方法將單細胞類群映射到空間轉錄組數據上。
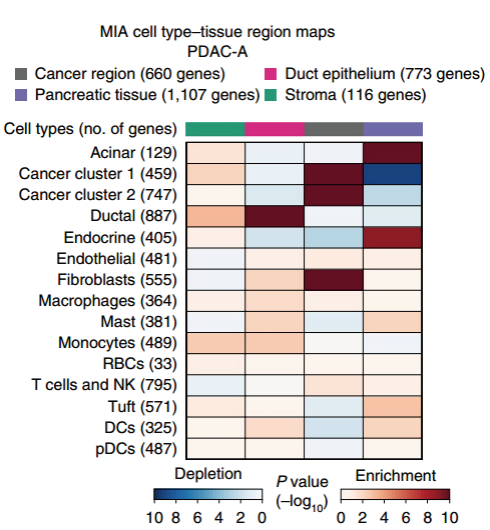
備注: MIA 熱圖,上方的顏色條反映了 ST 區域的子聚類(cancer region,Pancreatic tissue,Duct epithelium 和 stroma)。
左側代表不同的細胞類群。
色塊代表 enrichment 或者 depletion。
Enrichment 代表該細胞類群富集到了該區域。
Depletion 代表該細胞類群在該區 域缺失。

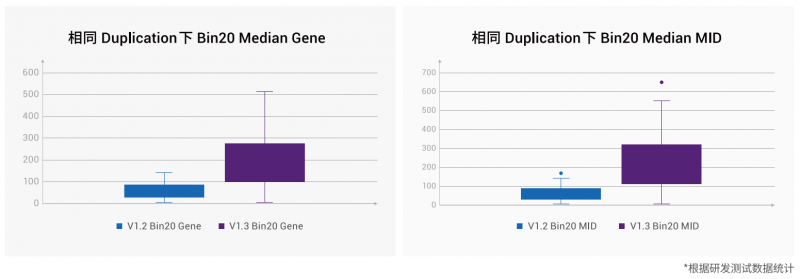
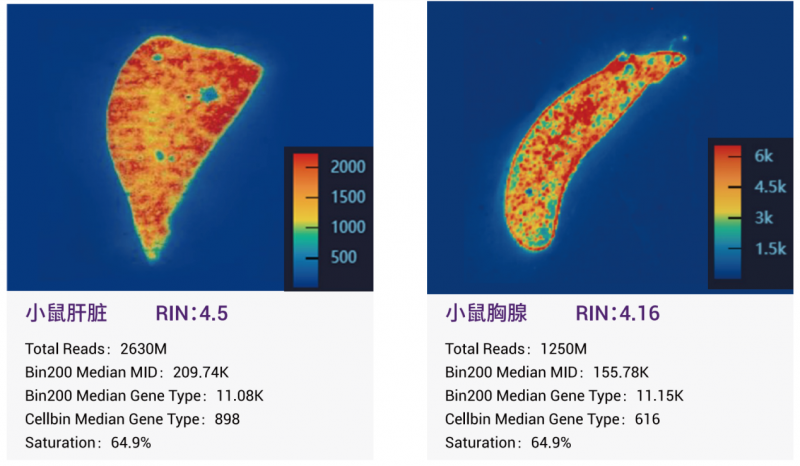
1、捕獲基因數顯著提升:
基于同組織相鄰切片、相同數據飽和度下,統計了已測試的所有組織樣本,Bin20 水平捕獲的 Median Gene Type 提升中位數比例為~149%。Meidan MID 提升中位數比例為~224%。捕獲效率顯著提升,助力進行更深入的單細胞空間分析。
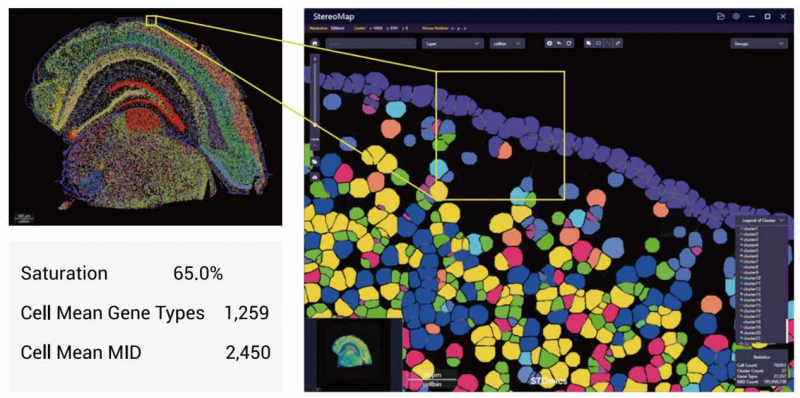
2、輕松實現 Cellbin 分析:
通過圖像識別技術,對細胞核進行識別和分割并獲得 Celbin。基于 Cellbin 水平捕獲到的更多空間轉錄組信息,以單細胞分辨率精細探索基因表達空間特征。
3、樣本質量兼容性更高:
RIN 值的質控要求調整為 RIN≥4,允許檢測更多長期保存的降解度更高的樣本,樣本質量兼容性更高。
4、同試劑盒支持同片細胞核 /H& E 染色:
H&E 封片劑集成進試劑盒,支持同一套試劑盒在同一張切片上靈活選擇 ssDNA 染色 /H&E 染色,開展多 模態數據分析及挖掘。
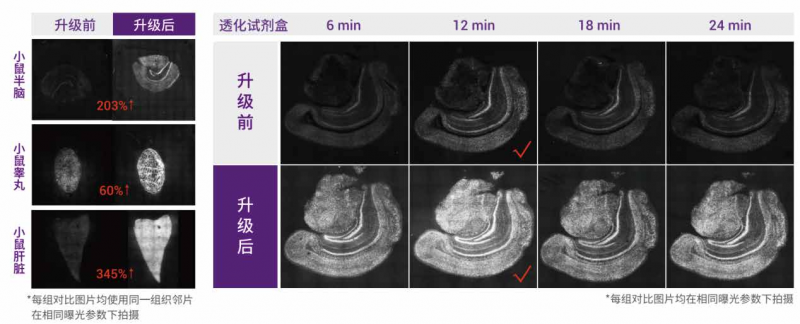
5、有效提升透化熒光信號強度:
透化試劑升級后,可以有效提升透化熒光信號強度,更有利于選擇最佳透化時間。
6、工作流程更快速便捷:
實現部分試劑預混,試劑管數減少,生化流程整體可縮短~4 小時,操作更簡單流暢,研究人員 1 天即可獲得純化后的 cDNA 產物。

7、分析工具強大且易用
全新升級的數據分析工具安裝配置和操作使用更簡單便捷,交互友好性更強,可視化能力更豐富,可兼容所有第三方分割算法的結果。

1、新鮮組織樣本包埋
目前新鮮組織的包埋方法有兩種,一種是液氮 + 異戊烷法;另一種的干冰法。對于臨床手術切下來的組織樣本一般使用干冰的包埋方法。對于穿刺樣本等一些較小,較輕的樣本,一般推薦用液氮 + 異戊烷的方法 進行冷凍。OCT 包埋組織塊可以在?80oC 的密封容器中長期保存,或立即進行冷凍切片。有些樣本比較特殊:肺組織,腦(人 + 小鼠 + 大鼠)這種樣本取下后,不要放入在任何液體里,如果表面有血液,只需要用 PBS 沖洗擦干后,進行包埋。
2、冷凍切片、組織樣本質控及貼片
由于空間轉錄組檢測的是組織中的 RNA,因此要對切片中的 RNA 質量進行檢測。我們一般取 10 片組織切片進行 RNA 抽提并質檢,確定組織中 RNA 完整性(華大 V1.3:RIN>4)。所以要求我們的組織樣本至少有 1cm 的厚度,以便完成所有的實驗。
3、組織優化
進行組織優化芯片探索的目的是摸索樣本的最佳透化條件,保證組織切片中的 mRNA 能夠充分釋放。該步驟是獲取真實實驗結果的必要條件。否則,我們無法判斷是基因表達高低到底是否是因為透化不充分導致。因此:每個樣本建議都要做透化,尤其是臨床樣本。

空間位置信息,或者細胞在組織中天然的狀態在研究過程中其實具有十分重要的價值,特別針對某些 研究領域,如發育生物學(不同位置的細胞接受不同的信號濃度梯度、響應不同的外界刺激,具有不同的發 育命運)、腫瘤生物學(腫瘤組織與癌旁組織的區別,腫瘤細胞侵潤過程中腫瘤細胞的變化與對正常細胞的 影響,腫瘤轉移的不同過程階段等)、腦神經科學(不同腦區位置的神經元結構、神經連結,中間神經元投射,突觸前后,神經膠質相互影響等等),細胞來源的位置信息是極為關鍵的決定因素。常見空間轉錄組的應用方向主要在腫瘤學,免疫學,發育生物學,神經科學及病理學等方向。
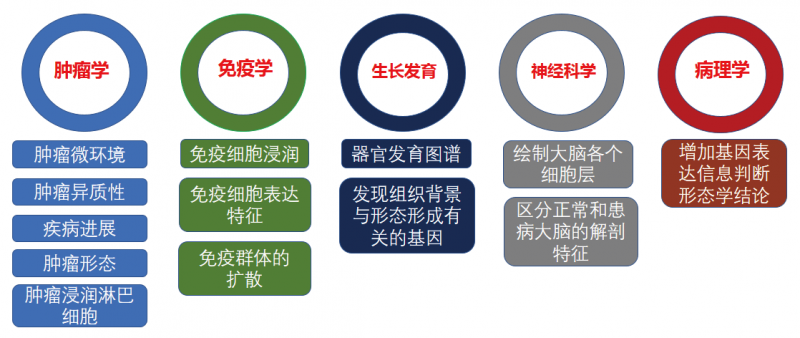
圖 空間轉錄組的應用方向

截止 2024 年 5 月,利用 DNBelab C 系列高通量單細胞 RNA 測序技術進行研究發表的文章累計 80 多篇,尤其是在 Nature,Cell,Cell Research,Immunity 等國際頂刊也發表過多篇代表性文章。
文獻案例 1:
Cell 突破!中國科學家首次重構高分辨率人類數字 3D 原腸胚
3D reconstruction of a gastrulating human embryo[3]
發表雜志:Cell
影響因子:45.6
發表時間:2024 年 5 月
摘要: 原腸運動(gastrulation)是指大部分動物胚胎發育中都會經歷的一個階段。在本階段中,只有一
層細胞的囊胚會發生重組,形成一個含有三個胚層(即外胚層 ectoderm、中胚層 mesoderm、內胚層
endoderm)的結構,而新形成的三個胚層細胞會組合并協調發育為各種器官。每一個胚層的細胞都能發育
為特定的器官和組織。研究者基于 Stereo-seq 對一個完整的 CS8 原腸胚胚胎及進行冷凍切片并測序,得到
從前端到后端完整的空間轉錄組信息,結合機器學習算法進行三維對齊,形成整個 CS8 胚胎的三維空間轉
錄組圖譜,從而實現完整的胚胎 3D 構建。通過對基因三維分布和參與原腸胚形成過程的基本細胞進行分析,研究者對不同的細胞亞型進行注釋,關注了有關的分子調控網絡并探討了 CS8 胚胎中重要發育事件
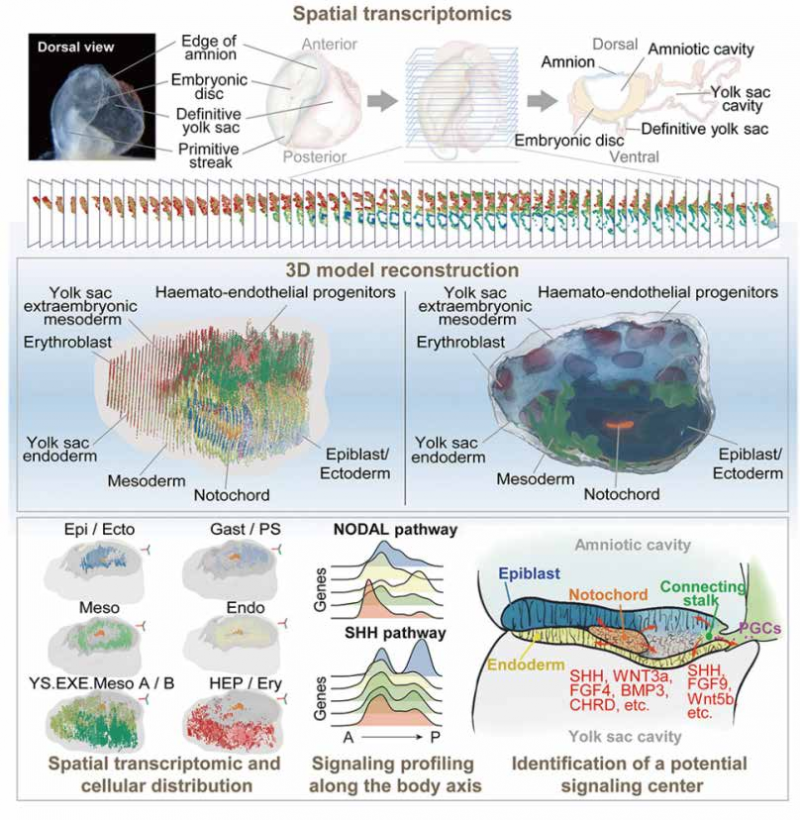
文獻案例 2:
Stereo-seq 繪制小鼠器官發生圖譜
Spatiotemporal transcriptomic atlas of mouse organogenesis using DNA nanoball-patterned arrays.[4]
發表雜志:Cell
影響因子:45.6
發表時間:2022 年 5 月
摘要: 結合 DNA 納米球(DNB)模式陣列和原位 RNA 捕獲技術,建立了 Stereo-seq(SpaTial Enhanced REsolutionOmics-sequencing)技術,相較當前其他空間轉錄組技術,該技術擁有最大的捕獲面積(最大 174.24 cm2)、最靈敏的基因捕獲(1,450 個 UMI/100μm2)和單細胞分辨率;應用 Stereo-seq 對 C57BL/ 6 小 鼠胚胎發育第 9.5 天(E9.5)至第 16.5 天(E16.5)產出了共 53 張矢狀切面的轉錄組圖譜,其中包括來自同一個 E16.5 胚胎的 13 張連續切片,并進一步描述了小鼠胚胎發育中晚期的器官發育基因的空間表達模式以及器 官發育的軌跡,構建了小鼠器官發生時空轉錄組數據庫(MOSTA);基于核酸染色影像進行細胞邊界識別,獲取了 E16.5 小鼠全胚胎具于空間位置的單細胞時空轉錄組信息,并在同一張切片上鑒定了 4 種上皮細胞 亞型和 6 種成骨細胞亞型的空間分布情況,描述了前腦的抑制性神經元從內側神經節隆起至皮層的遷移軌 跡;在 E12.5、E14.5 以及 E16.5 小鼠的背側中腦描述了中腦發育過程中的細胞分布異質性,并在中腦的腦室 區發現中腦區域放射狀膠質細胞向神經細胞祖細胞或膠質細胞祖細胞兩個分支的分化軌跡以及在中腦發 育過程中的時間分布異質性,找到了決定放射狀膠質細胞分別向兩個分支發育的關鍵微環境因子和調控 因子;利用 Stereo-seq 構建的小鼠中晚期的胚胎時空轉錄組圖譜,描述了人類發育缺陷相關 1,959 個基因 在小鼠胚胎中表達模式,并在單細胞精度下研究了由 WNT5A 基因突變導致的羅賓諾綜合征(Robinow Syndrome)在小鼠上顎和肢體中累及的細胞類型,證明了應用 MOSTA 解析發育過程中疾病相關基因表達 的時空窗口和潛在累及細胞和器官方面的潛力。
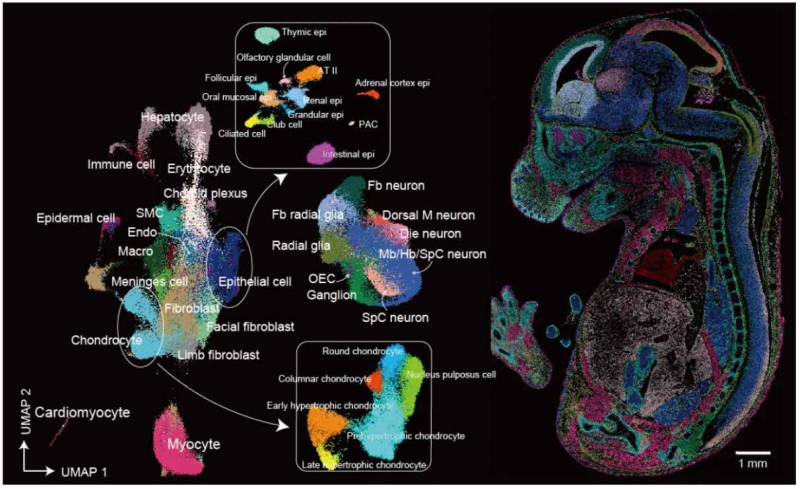
文獻案例 3:
基于 scStereo-seq 技術揭示擬南芥葉片中區域特異性細胞亞型和單細胞空間轉錄組分析
The Single-cell Stereo-seq reveals region-specific cell subtypes and transcriptome profiling in Arabidopsis leaves.[5]
發表雜志:Developmental Cell
影響因子:10.7
發表時間:2022 年 5 月
摘要: 基于 Stereo-seq 技術,結合植物細胞具有細胞壁這一特性,建立了廣泛適用于植物的單細胞空 間轉錄組技術 scStereo-seq(single-cell SpaTial Enhanced REsolution Omics-sequencing),首次在植 物研究領域中應用并繪制了擬南芥(Arabidopsis)葉片的單細胞空間轉錄組圖譜;植物單細胞研究中,存 在部分細胞亞型因分子特征高度相似,而難以有效地區分和研究的問題,scStereo-seq 應用于擬南芥莖生 葉橫切面,成功將高度相似的細胞亞型進行有效區分和分子特征的解析(如表皮細胞中的上表皮細胞和下 表皮細胞,葉肉細胞中的柵欄細胞和海綿細胞);首次從單細胞水平揭示了光合作用相關基因(PQL1、LHCA6、PSB29、PPL2、FNR1)的表達水平在空間上呈現從主葉脈到葉邊緣方向上的梯度變化的趨勢;利用 細胞空間位置信息,構建了不同類型細胞的空間發育軌跡,發現在維管細胞中,主葉脈區域的細胞相較于 葉邊緣細胞,占有更高比例的分化程度較低的細胞;而在表皮細胞和保衛細胞的發育軌跡未能觀察到明顯 的空間分布差異特征。
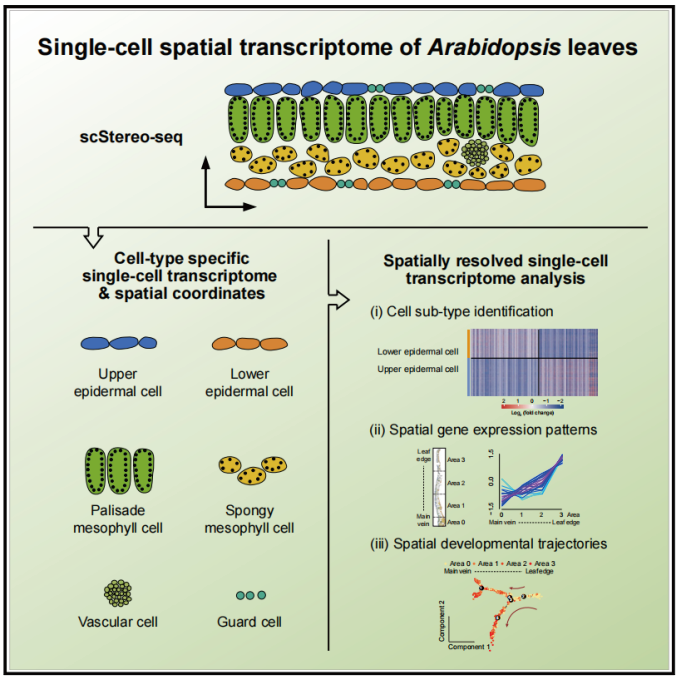
| 參考文獻: [1]. St?hl PL, Salmén F, Vickovic S, et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science 2016, 353(6294):78-82. [2]. Peng G, Suo S, Chen J, et al. Spatial Transcriptome for the Molecular Annotation of Lineage Fates and Cell Identity in Mid-gastrula Mouse Embryo. Dev Cell 2016, 36(6):681-697. [3]. Xiao Z, Cui L, Yuan Y, et al. 3D reconstruction of a gastrulating human embryo. Cell. 2024 May 23;187(11):2855-2874. [4]. Chen A, Liao S, Cheng Met, et al. Spatiotemporal transcriptomic atlas of mouse organogene-sis using DNA nanoball-patterned arrays. Cell. 2022 May 12;185(10):1777-1792. [5]. Xia K, Sun HX, Li J,et al. The single-cell stereo-seq reveals region-specific cell subtypes and transcriptome profiling in Arabidopsis leaves. Dev Cell. 2022 May 23;57(10):1299-1310. |

